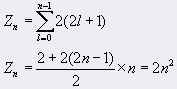|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
关于量子数 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
我们根据量子力学阐明了氢原子的结构,氢原子中电子的量子态用量子数n, l, ml来描述。在考虑到电子具有两种自旋态,则一个电子的运动状态可由四个量子数n, l, ml, ms完全确定。 主量子数 n =1,2,3,…, n 大体上决定原子中电子能量; 角量子数l =0,1,2,…(n-1), l 决定电子的轨道角动量,并对能量稍有影响; 磁量子数 ml = 0,±1,±2,…±l,ml可以决定轨道角动量在外磁场方向上的分量; 自旋量子数ms = ±1/2 ,ms决定电子自旋角动量在外磁场方向上的分量。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
填充规则 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子中的电子填充到各壳层中时遵循一定的规律,即泡利原理、能量最低原理、洪特定则。 下面根据泡利原理和能量最小原理计算每个主壳层中最多可容纳的电子数目。
根据泡利原理,可以算出原子中具有相同主量子数 n 的电子数目最多为
当n =1,l =0 时K壳层上可能有2个电子,这个组态用1s2表示,1s2是光谱学符号。 当n =2,l =0时(L壳层,s分壳层),可能有两个电子,组态以2s2表示; 当n =2,l =1时(L壳层,p分壳层),可能有6个子,组态以2p6表示。 下表列出了原子内各主壳层和分壳层上可容纳的最多电子数。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
元素周期表 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
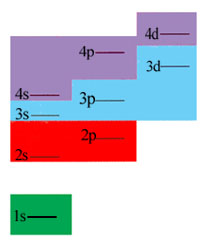
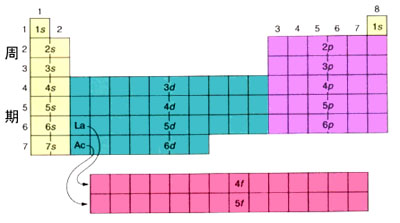
1859年门捷列夫根据元素的物理性质和化学性质将它们组织到元素周期表中,元素周期表中一百多种元素排成7个周期,每个周期的元素个数依次为2、8、8、18、18、32、32,同上表中每个主壳层可容纳的电子数并不完全吻合。这是因为能级不完全由主量子数n 决定,也与角量子数 l 有关。按照能量最小原理,电子按能级的高低从低到高占据原子中的各个能级。 我国科学家徐光宪总结出的规律为:能级高低以(n +0.7l)值来确定,该值越大,能级越高。例如4s和3d两个状态,4s的(n+0.7l)=4,3d的(n+0.7l)=4.4,所以4s能级低于3d能级,这样,4s态应比3d态先为电子占有。下左图画出了各能级的高低。
由此可得到所有元素的电子组态,即电子的壳层结构,如上右图所示,它能很好地说明元素周期表中各个周期的形成。下表列出了元素周期表中前4个周期原子内电子按壳层分布。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||